

利用蛋白质的结构变化鉴定氙气-蛋白质相互作用组
大家好!本周推荐一篇发表在JACS上的文章,文章标题“Discovery of the Xenon−Protein Interactome Using Large-Scale Measurements of Protein Folding and Stability”,通讯作者是来自杜克大学化学系的Beratan教授和Fitzgerald教授。Fitzgerald课题组致力于研究蛋白质与配体结合过程中的热力学性质。

惰性气体在细胞凋亡、炎症等生命过程中展现出一定的生物活性。但是,与惰性气体存在相互作用的生物分子有哪些,其背后的分子机制是怎样的,人们对此仍知之甚少。本文,作者结合氧化速率分析蛋白质稳定性(stability of proteins from rates of oxidation ,SPROX)方法和限制性蛋白质水解(limited proteolysis,LiP)方法,基于质谱技术发展了一套在蛋白质组规模上检测气体-蛋白质相互作用的操作流程,并以此鉴定出氙气-蛋白质相互作用组。

首先介绍以上两种技术的基本原理。SPROX技术(DOI:10.1021/pr200403c)通过测定甲硫氨酸的氧化反应性表征蛋白质的结构稳定性。具体而言,当蛋白质结构发生变化时(如,配体结合导致的结构变化),暴露于溶剂中的甲硫氨酸数量(氧化反应性)可能发生变化。LiP技术(DOI:10.1038/nbt.2999)思路大致相同:当蛋白质结构发生变化时,暴露出的蛋白酶切位点不同(LiP酶,指代广谱性蛋白酶),质谱鉴定到的肽段片段也将发生变化。
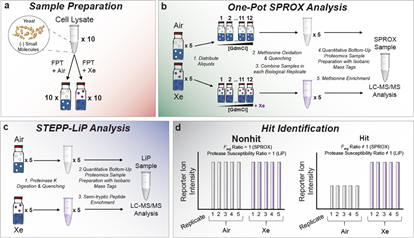
本文中,作者开发了一套脱气程序FPT,用于氙气-蛋白质样品的制备。应用上述技术,比较了空气和氙气下的实验结果。随后的生信分析表明,氙气的互作组集中在与ATP相关的蛋白质中。最后,利用分子动力学模拟和分子对接技术研究了Actin等蛋白中氙气的结合位点。结果表明,氙气的结合位点与核苷酸结合位点可能相近。
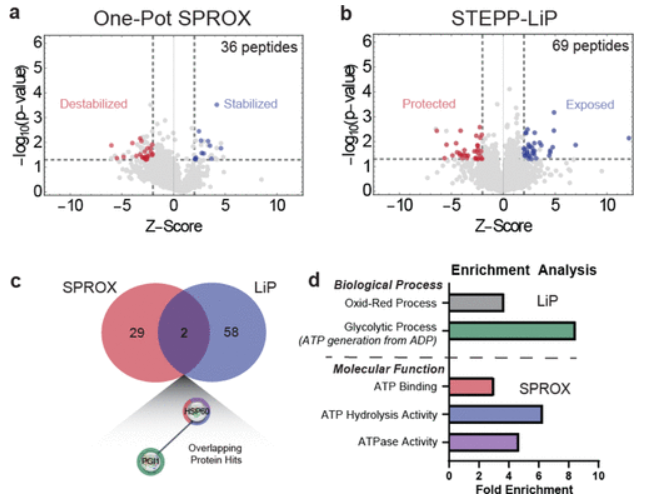
展望这一流程可以拓展到具有生物活性的其它惰性气体(如氩气)中,并且鉴定气体的蛋白质互作组有助于推动蛋白质类气体检测器和传感器的研究。

24小时 贴心服务:如果您对以上纽瑞德气体感兴趣或有疑问,请点击和我联系网页右侧的在线客服,或致电:400-6277-838,纽瑞德气体——您全程贴心的采购顾问。
- 上一篇:俄乌战争后遗症,半导...
- 下一篇:乌克兰两家氖气公司确...





